Foram preparadas várias soluções com concentrações diferentes de ácido cítrico com a intenção de observar laboratorialmente a função que define o pH com uso de um pHmetro.
Concentração teórica de H3O+ do ácido cítrico obtidos nas concentrações de 0.1, 0.2, 0.3, 0.4 e 0.5 mol/L tiveram os seguintes valores de pH Práticos e teóricos:
| Concentração de [H3O+] (mol/l) |
pH Teórico |
pH Prático (PHmetro) |
| 0,0083666 |
2,07745098 |
1,88 |
| 0,01183216 |
1,926935982 |
1,77 |
| 0,014491377 |
1,838890353 |
1,64 |
| 0,016733201 |
1,776420984 |
1,54 |
| 0,018708287 |
1,727965978 |
1,44 |
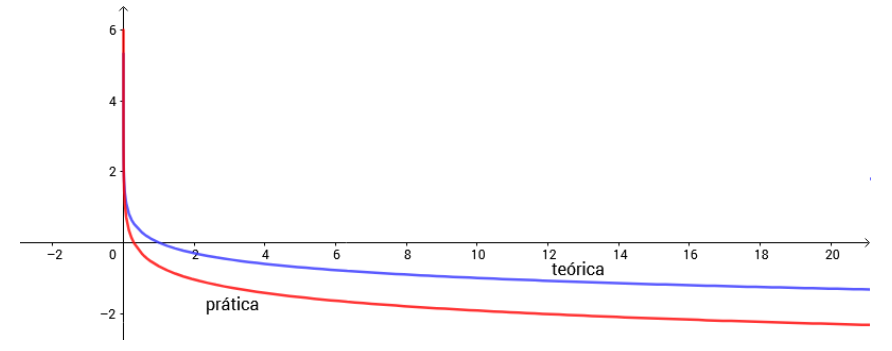
Foram observadas diferenças entre os dois valores de pH, que estão em função dos valores da concentração de H3O+.
Enquanto o pH prático segue a função h(x) = - Log_10(x), a função obtida com a preparação das soluções e medição no pHmetro foi definida pela função
g(x) = -1,2466Log_10(x) - 0,6772, são funções similares, mas com algumas diferenças geradas em g.
Definindo as funções como f(x) = -ALog_10(x)+B. A função g possui coeficientes “A” e “B” diferentes de h, gerando graças a “B” uma translação vertical, e “A” uma homotetia vertical. Pequenas alterações na função que podem surgir a partir de erros experimentais que podem surgir decorrentes da calibração do pHmetro.
Gráfico - Concentrações teóricas e práticas em função do pH
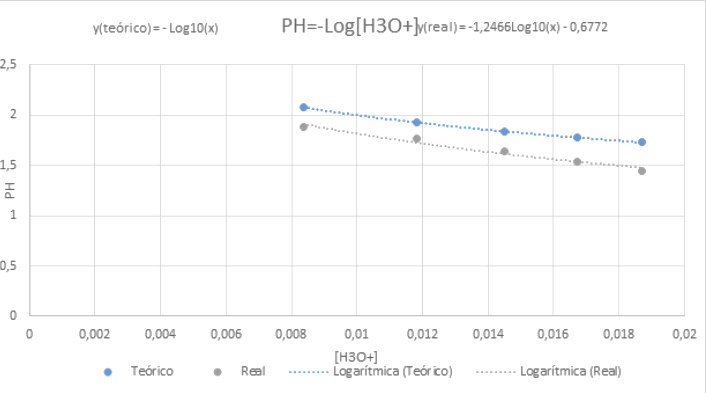
Comparação - gráficos da função obtida na prática laboratorial e da função teórica